1. Einleitung
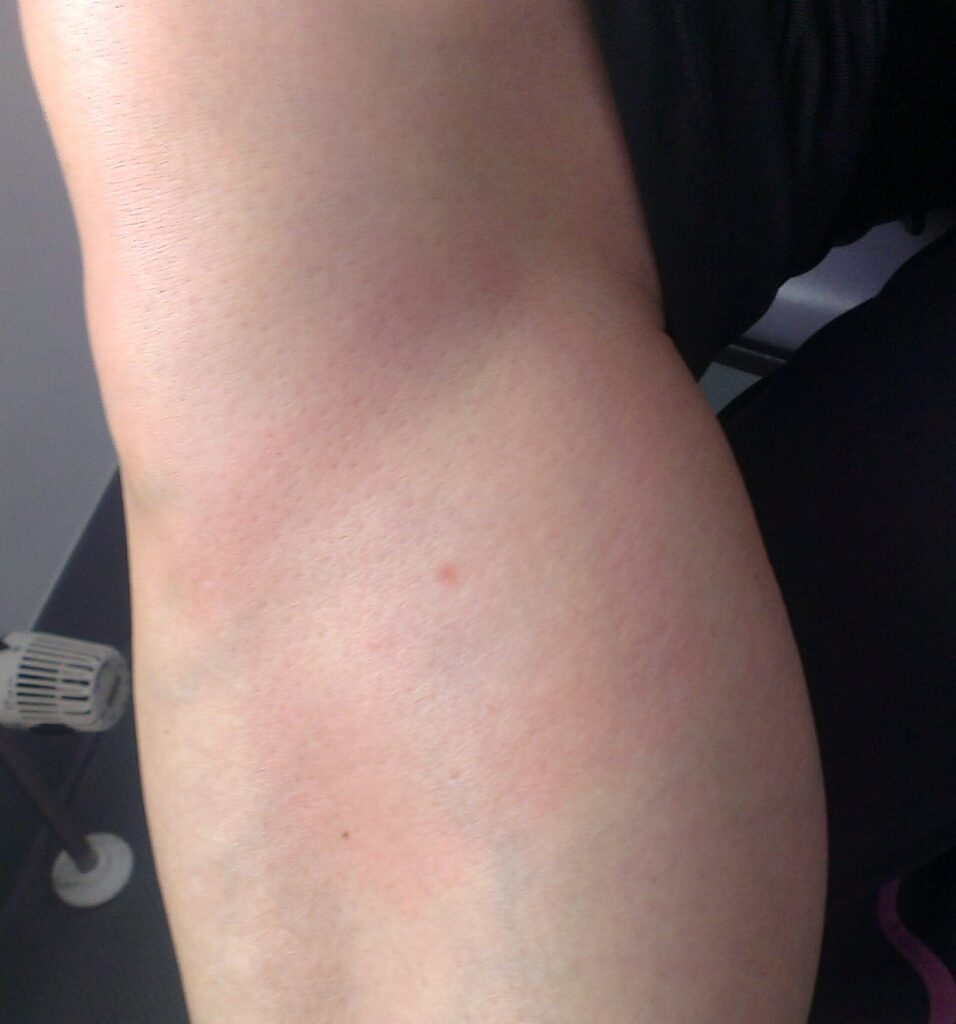
Die Diagnose einer Borrelieninfektion gestaltet sich nicht immer einfach. Sie beruht zunächst auf der klinischen Symptomatik und ggf. auf einer entsprechenden Anamnese. Ist z. B. ein Zeckenstich erinnerlich und tritt nach 2 bis 3 Wochen an dieser Stelle eine kreisförmige Rötung auf, die zentrifugal wandert (Erythema migrans, EM), so kann mit hoher Sicherheit von akuten Borrelieninfektion ausgegangen werden.
Leider ist die Situation nicht immer so eindeutig. Häufig ist ein Zeckenstich nicht erinnerlich oder wird bei chronischen Infektionen, die auch Monate bis Jahre nach einem solchen Stich auftreten können, nicht mit dem vorliegenden Beschwerdebild in Verbindung gebracht. Auch ist das Beschwerdebild nicht immer typisch und spezifisch. Aus diesem Grund ist es in der Regel notwendig durch Diagnostik im Labor zusätzliche Informationen zu erhalten.
2. Labordiagnostik
Grundsätzlich unterscheidet man zwischen direktem und indirektem Erregernachweis.
A. Der direkte Erregernachweis
Er bleibt speziellen Fragestellungen vorbehalten, da er sehr aufwändig ist und trotzdem je nach Fragestellung nur eine eingeschränkte Sensitivität aufweist.
Normalerweise werden zwei Methoden angewandt.
I. Anzucht der Borrelien in speziellen Nährmedien.
Vorteil der Methode ist, dass das Borrelienisolat für weitere Tests zur Verfügung steht. Der Nachteil ist jedoch, dass die Anzucht sehr lange dauert und möglicherweise nicht alle Borrelienuntergruppen gleich gut wachsen.
II. Nukleinsäure Amplifikationstechniken (NAT) z.B. mittels Polymerasekettenreaktion (PCR)
Der Vorteil dieser Methode ist, dass heutzutage sehr schnell (innerhalb von 1 Tag) ein Ergebnis verfügbar ist. Ein zweiter Vorteil gegenüber der Anzucht ist, das in verschiedenen Körpermaterialien eine höhere Empfindlichkeit erreicht wird. Nachteile der Methode sind zum einen, der relativ hohe Preis und die Gefahr, dass neue Borrelienuntergruppen möglicherweise nicht erkannt werden.
Abgesehen von Proben aus der Haut sind beide Methoden bezüglich Ihrer Empfindlichkeit nicht optimal.
B. Aus diesen Gründen basiert die Borreliendiagnostik vor allem auf dem indirekten Erregernachweis.
Dabei handelt es sich um den Nachweis der Immunreaktion des Körpers auf die Infektion mit Borrelien. In der Regel werden hier die gegen Borrelien gebildete Antikörper gemessen. Es handelt sich um eine serologische Diagnostik.
3. Serologische Diagnostik von Borrelieninfektionen
In den vergangenen Jahren kamen zum Nachweis von Antikörpern gegen Borrelien verschiedene Methoden zum Einsatz. Heute werden in der Regel noch drei Methoden eingesetzt:
1. Der indirekte Immunfluoreszenztest (IIFT)
2. Der Enzymimmunoassay (EIA oder ELISA)
3. Der Immunoblot (IB), wird auch Westernblot genannt
3.1. Antigene in der Borreliendiagnostik
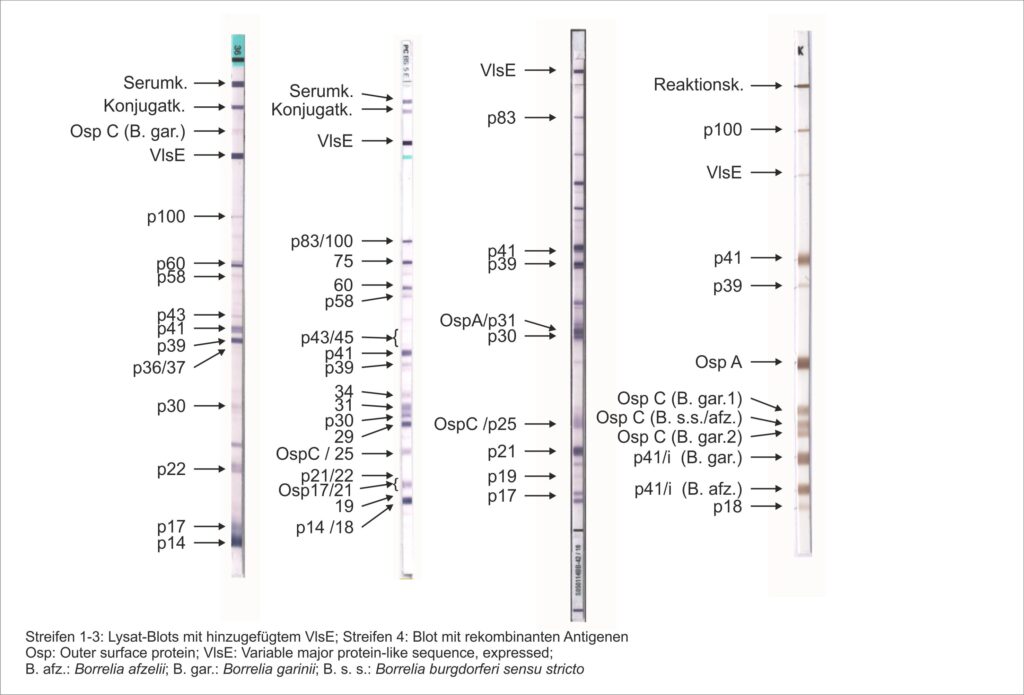
Zum Nachweis von Antikörpern gegen Borrelien wurden zunächst lediglich Vollantigene verwendet. Diese kamen und kommen bei der Herstellung von Objektträgern für den IIFT und als Lysat-Vollantigene zur Herstellung von ELISA und IB zum Einsatz. (siehe Streifen 1-3)
Heute werden hierfür unterschiedliche Borrelienstämme verwendet: Während früher hauptsächlich die in Nordamerika vorkommende Borrelia burgdorferi sensu stricto (z. B. der Stamm B31) verwendet wurde, werden für europäische Testsysteme heute vorwiegend B. afzelii (z. B. der Stamm pKo) verwendet. Hintergrund ist, dass im Gegensatz zu Nordamerika, wo nur ein human pathogener Borrelienstamm (B. burgdorferi s.s.) bekannt ist, in Europa mindestens drei humanpathogene Stämme (nämlich: B. burgdorferi s.s., B. afzelii, B. garinii) vorkommen. Weitere Kandidaten (z. B. B. spielmanii, B. bavariensis, B. valaisiana) sind bekannt und führen ebenfalls zu Infektionen beim Menschen. Zusammen gefasst werden alle diese Borrelienstämme unter dem Überbegriff B. burgdorferi sensu lato (s.l.) und sind von den Rückfallfieber-Borrelien abzugrenzen.
Wegen dieser Erregerheterogenität wurde ein Antigen gesucht, welches die Antikörper gegen möglichst viele Borrelienstämme erkennen kann. Hier wurde B. afzellii als am besten geeignet angesehen. In neuerer Zeit nimmt jedoch die Kenntnis zu, dass unterschiedliche Borrelienstämme zu unterschiedlichen Organmanfestationen führen können. Bei der Neuroborreliose (NB) zum Beispiel wird mit Abstand am häufigsten B. garinii isoliert und diese Tatsache wirft die Frage auf, ob zur Diagnose der NB nicht besser B. garinii als Antigen verwendet werden sollte.
Neben diesen Tests, die auf Lysat-Antigenen basieren, werden seit etlichen Jahren Testsysteme mit rekombinanten Antigenen hergestellt. Hierbei werden bekannte Borrelienproteine, z.B. die Oberflächenproteine (Outer surface protein = Osp) rekombinant hergestellt. Vorteile der rekombinanten Herstellung sind unter anderem, dass nur spezifische Antigene verwendet werden können und auf kreuzreagierende Antigene verzichtet wird. Ein weiterer Vorteil ist, dass die Konzentration der einzelnen Antigene variiert werden kann und man z. B. für den IgM-Test eine andere Mischung und Konzentration erwenden kann als für den IgG-Test. Des weiteren besteht die Möglichkeit Antigene verschiedener Borrelienstämme zu kombinieren. Dies ist bei den Lysat-Tests nur in begrenztem Maße möglich. (siehe Streifen 4)
3.2. Neue Antigene für die Borreliendiagnostik

Sequenzierung des Borreliengenoms und die Anstrengung ein Antigen für einen Impfstoff gegen die Borreliose zu entwickeln, führte zur Entdeckung weiterer Borrelienantigene den sog. „in vivos“. Hierbei handelt es sich um Borrelienproteine, die lediglich in vivo exprimiert werden, d.h. diese Proteine sind in den, in der Kultur hergestellten, Lysat-Antigenen nicht enthalten. Der Grund hierfür ist, dass die Borrelien zur Anpassung an die Umgebung (z.B. Zeckendarm, Säuger und Kultur) nicht immer die selben Antigene exprimieren. „In vivos“ müssen rekombinant hergestellt werden und werden auch beim Lysat-Blot separat aufgetragen.3.3. VlsE (Variable major protein like sequence Expressed)Das wichtigste neue Antigen ist das VlsE . Es handelt sich um ein Antigen welches dem Variable major Protein (VMP) der Rückfallfieber-Borrelien sehr ähnlich ist (VMP like). Dieses Protein hat eine hohe Variabilität. Trotzdem konnten konstante Regionen identifiziert werden, die als Testantigen geeignet sind. IgG-Antikörper gegen dieses Protein werden sehr früh gebildet, teilweise schon zusammen mit OspC-IgM. Antikörper gegen VlsE werden i.d.R. auch bei fortgeschrittenen Infektionsstadien noch zuverlässig nachgewiesen.
Nomenklatur der Borrelienantigene und ihre Bedeutung für die Diagnostik
| Mögliche Molekular- gewichte [kDa] | MIQ 2000 (DIN 58969-44) | Dressler-Kriterien (mod.) | Antigen | Kreuz- reaktivitat | Bemerkung |
| VlsE | VlsE | Variable major protein (VMP) sequence Expressed | Gering | IgG-AK häufig schon im Frühstadium nachweisbar. Nur in vivo exprimiert. | |
| 83, 88, 93, 100 | p83/100 | 93 | Protoplasma- zyliner oder Flagellum assoziiert? | Gering | chromosomal kodiert. Antikörper sind typisch für ein spätes Infektionsstadium |
| 75 | Hsp (Heat Shock Protein) | Hoch | Wenig untersucht | ||
| 66 | 66 | Hsp | Hoch | Tritt häufig auch bei anderen bakteriellen Infektionen auf | |
| 60 | Hsp60,GroEL | Hoch | Tritt häufig auch bei anderen bakteriellen Infektionen (E. coli, Treponema, Legionella, Pseudomonas u.a.) auf | ||
| 58 | p58 | 58 | Gering | Noch nicht charaktrisiert; lässt sich von Hsp60 abgrenzen | |
| 56/55 | Hoch | ||||
| 47 | Unklar | ||||
| 45 | p43 | 45 | Gering | Noch nicht charaktrisiert | |
| 41 | (p41) nur für IgM | 41 | Flagellin-Protein | Bekannte Kreuzreaktionen zu anderen Spirochäten und zu geißeltragenden Bakterien. Antikörper treten früh auf. | |
| 39 | p39 | BmpA 39 | Borrelia membrane Protein A | Gering | Diese Antikörper treten häufig schon früh auf. |
| 37 | Unklar | Wenig untersucht | |||
| 35 | Unklar | Wenig untersucht | |||
| 34 | 34 | OspB (outer surface protein B) | Gering | Antikörper treten spät auf und sind nur bei einem Teil der Patienten nachweisbar. | |
| 31 | 31 | OspA | Gering | Es sind mindestens sieben unterschiedliche OspA bekannt | |
| 30 | p30 | 30 | Gering | Noch wenig untersucht. | |
| 29 | 28 | OspD | Gering | ||
| 26 | OspF | Unklar | Nur experimentell beschrieben. | ||
| 25,24,23,22,21 | OspC | 21 | OspC | Gering | Erscheint früh, wichtigster Marker der IgM-Antwort; es sind mindestens 13 unterschiedliche OspC bekannt. |
| 22 | p21 | Gering | Noch wenig untersucht. | ||
| 21 | Osp17 | 18 | DbpA (Decorin binding Protein A) | Gering | Bindung an Decorin auf der Wirtszelle |
| 19 | OspE | Unklar | Nur experimentell beschrieben. | ||
| 18,13 | p14 | Gering | Bei B. afzelii als immunogen beschrieben |
4. Serologisches Vorgehen bei V.a. Infektion mit Borrelien
Im Allgemeinen wird eine serologische Stufendiagnostik durchgeführt. Dies ist auch im EBM (Einheitsbewertungsmaßstab) so vorgesehen und in der MIQ2000 und der DIN 58969-44 dokumentiert.
Zunächst wird ein empfindlicher Screeningtest (z.B. IFT, EIA) durchgeführt. I.d.R. werden heute EIAs eingesetzt, da die Abarbeitung sehr standardisiert und rationell durchgeführt werden kann. Die Antigene dieser Tests werden heute i.d.R. durch VlsE ergänzt um die Sensitivität des IgG-Tests in der Frühphase zu verbessern.
Bei positivem oder grenzwertigem Ergebnis wird als zweite Stufe ein Immunoblot durchgeführt. Dieser Test dient zur Überprüfung der Spezifität. Allerdings muss berücksichtigt werden, dass es gerade in der Frühphase zu diskrepanten Ergebnissen zwischen EIA und IB kommen kann. Z.B. führt ein positives VlsE-Signal im IgG i.d. R. nicht zu einem positiven Blotergebnis.
Zur Bewertung des IB existieren spezielle Kriterien, nach denen ein IB-Ergebnis als positiv zu werten ist:
Bei einem Lysatblot mit B.afzelii als Antigen sind diese (siehe auchTabelle 1):
– IgG: zwei Banden positiv von p83/100, p58, p43, p39, p30, OspC, p21, Osp17, p14 und VlsE
– IgM: eine Bande von p39, OspC, Osp17 oder sehr starke p41-Bande
Es gibt jedoch auch Hersteller die eigene Bewertungskriterien etabliert haben.
Abb.2: Immunoblots bei akuten Infektionen
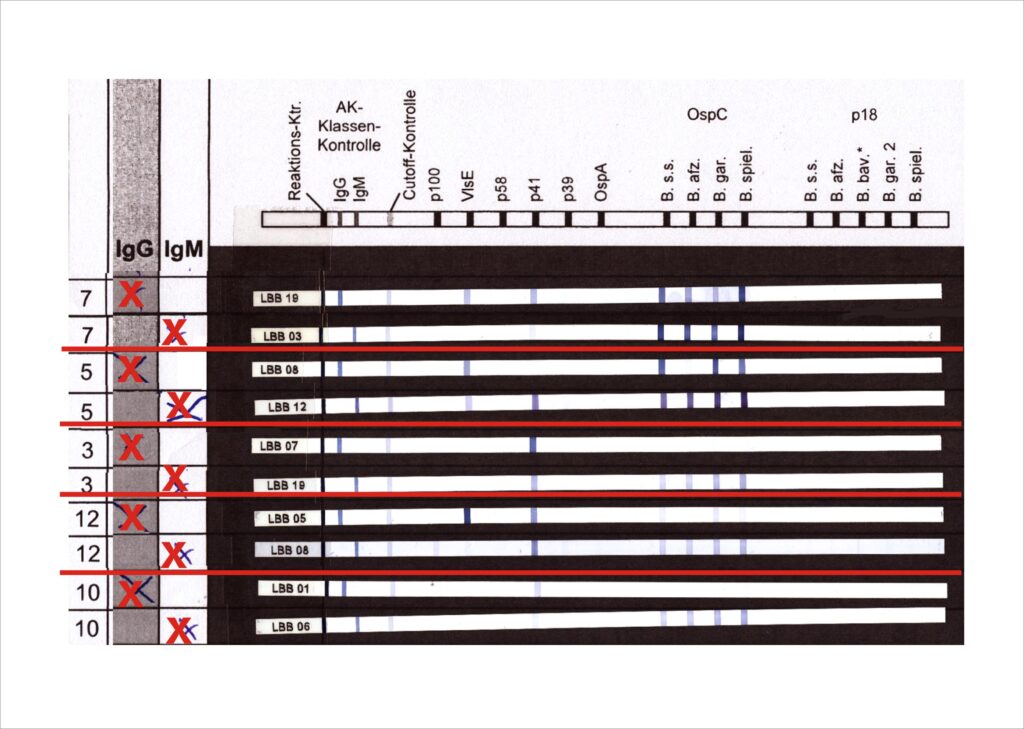
5. Antikörperbildung bei einer Infektion mit Borrelien
Die Frühphase der Infektion (Stadium I, füh-lokalisiert: Erythema migrans, Lymphozytom) ist zunächst durch Bildung von IgM-Antikörpern gekennzeichnet. Hier werden vor allem Antikörper gegen das OspC gebildet. Je nach Testsystem werden auch p41-Antikörper gefunden, die jedoch nicht so spezifisch sind wie die Immunantwort gegen OspC. Weitere relevante Banden sind gegen BmpA und Osp17 gerichtet, kommen jedoch deutlich selterner vor. IgM-Antikörper sind nach 3 – 6 Wochen zu erwarten. Die IgG-Antikörperbildung beginnt in der Regel später. Abweichend davon ist VlsE-IgG oft schon zeitgleich mit IgM-Antikörpern nachweisbar (Abbildung 3).
In der Phase der frühen Dissemination (Stadium II) werden zunehmend auch IgG-Antikörper gegen weitere Antigene gebildet. Die Kriterien für einen positiven IgG-IB werden zunehmend erfüllt. IgM-Ak sind häufig noch nachweisbar.
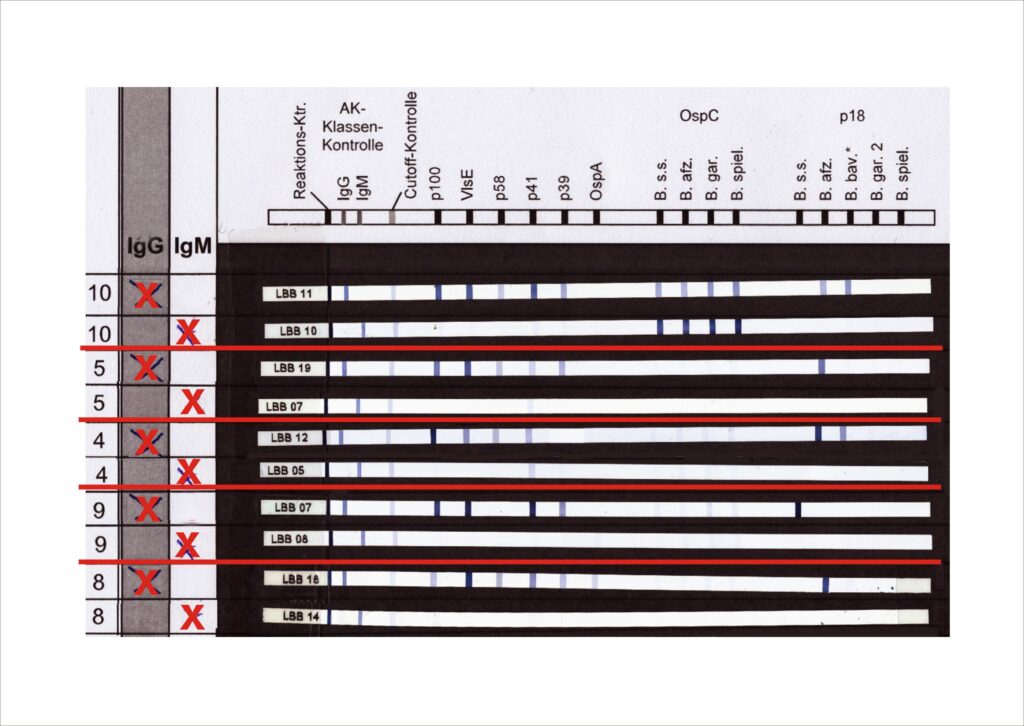
Im Stadium der chronischen (disseminierten) Infektion (Stadium III) sind IgG-Antikörper in der Regel eindeutig positiv nachweisbar. Häufig finden sich IgG-Blots mit sehr vielen spezifischen Banden (siehe Abbildung 4). Es sind auch sog. Spätbanden (siehe Tabelle 1) nachweisbar. IgM-Antikörper können nachweisbar sein müssen aber nicht.
Nach erfolgreicher Therapie fallen IgG- (und IgM-) Antikörper nur langsam ab. Eine kurzfristige Therapiekontrolle mittels Serologie ist deshalb nicht sinnvoll.
Abb 3: IgG-Immunoblots bei längerandauernde Infektionen
6. Bermerkungen zur Interpretation von serologischen Borrelienbefunden
– Fehlende IgM-Antikörper in der Frühphase der Infektion (früh-lokalisiert) z.B. bei EM schließen eine akute Infektion nicht aus. Dies kann seltener auch bei einer akuten NB oder Borrelien-bedingter Facialis Parese (FP) der Fall sein.
– Nach akuter (stadiengerecht behandelter Borreliose) können IgM-Antikörper sehr lange (mehrere Monate, seltener auch Jahre) nachweisbar sein. Die Persistenz von IgM-Antikörpern bei Beschwerdefreiheit ist keine Indikation zur erneuten Therapie.
– Eine Kontrolle nach erfolgter antibiotischer Therapie lässt keine Rückschlüsse auf den Therapieerfolg zu.
– Trotzdem kann eine Kontrolle 3 Monate nach Therapieende sinnvoll sein. Unter Therapie kann es zu einem deutlichen Anstieg der IgG-Antikörper kommen. Wird der Patient ein Jahr später wegen Kopfschmerzen untersucht, so könnte ein solcher Wert fälschlicherweise als Hinweis für eine floride Infektion gehalten werden. Nur der Vergleich mit der Kontrolle nach Therapieende ließe ein Aussage über Anstieg oder Abfall der Antikörperkonzentration zu.
– In den späten Infektionsstadien fehlen IgM-Antikörper häufig. Dies schließt eine chronische Infektion nicht aus.
– Treten im IgM-Blot sehr viele Banden auf (sieht aus wie ein IgG-Blotsteifen) besteht der Verdacht, dass es sich um eine unspezifische Reaktion (z.B. wegen vorhandenem Rheumafaktor, wenn keine Voradsorption) handelt.
– Das vom Labor mitgeteilte Testergebnis des Immunoblots sollte die Angabe der nachgewiesenen Banden beinhalten.
– Für die Beurteilung der Borrelienserologie sollte die Höhe der AK im EIA, die Anzahl der spezifischen Banden, die Art der Banden (frühe/späte Banden) und vorhandene Vorbefunde berücksichtigt werden. Die Beurteilung sollte unter Kenntnis der klinischen Symptomatik, der Erkrankungsdauer und bereits durchgeführter Therapien erfolgen.
6.1. Bemerkungen zur Diagnostik bei V. a. Neuroborreliose:
– Bei einer akuten Neuroborreliose können, im Gegensatz zu den meisten anderen Infektionserkrankungen, Antikörper in einigen Fällen zunächst nur im Liquor nachweisbar sein. Deshalb muss bei Verdacht auch bei negativen Ergebnissen im Serum immer der Liquor mitgetestet werden.
– Die Antikörperbestimmung im Liquor ist nur bei gleichzeitiger (im selben Testansatz) Untersuchung eines Serums vom selben Abnahmetag aussagekräftig. Der spezifische Antikörperindex (AI) ist der Wert von Interesse. Absolute Antikörperkonzentrationen im Liquor sind nahezu bedeutungslos, da (vor allem bei gestörter Liquor-Schrankenfunktion) erhebliche Antikörpermengen aus dem Serum übertreten können. Bei hohen Antikörperkonzentrationen im Serum wird man im Liquor immer Antikörper finden.
– Bei einer Neuroborreliose finden sich im Liquor i.d.R. weitere pathologische Befunde:
— Eine monozytäre Liquorpleozytose
— Eine Störung der Blut-Liquor-Schrankenfunktion gekennzeichnet durch eine Erhöhung des Albumin-Quotienten (hier werden auch schwere Schrankenfunktionsstörungen gefunden.
— Eine autochthone Gesamtantikörperproduktion mehrerer Klassen (IgG, IgM, IgA)
– Bei länger andauernder Infektion können mittels isoelektrischer Fokusierung (IEF) von Serum und Liquor auch oligoklonale Banden im Liquor gefunden werden.
– Unserer Erfahrung nach zeigt sich bei einer Borrelien-bedingten FP (vor allem bei Kindern) nicht immer der klassische Liquorbefund.
– Autochthon gebildete Antikörper können auch nach ausgeheilter NB noch lange (Jahre) nachweisbar sein.
– Der spezifische AI ist nicht geeignet als Verlaufskontrolle. Es handelt sich um einen relativen Wert, der in der Rekonvaleszenzphase (wenn die AK im Serum schneller sinken) sogar noch ansteigen kann.
– Die Differentialdiagnostik zwischen chronischer NB und einer Encephalitis disseminata (ED) ist klinisch und liquordiagnostisch nicht immer einfach. Im schlimmsten Fall können, bedingt durch die polyklonale Stimulation der B-Lymphozyten im ZNS, sogar autochthon gebildete AK gegen Borrelien nachweisbar sein. Trotzdem gibt es Hinweise, die für die eine oder andere Erkrankung sprechen:
– Bei der ED tritt i.d.R. keine Störung (allenfalls leicht) der Schrankenfunktion auf.
– Bei der ED ist i.d.R. eine Pleozytose nicht nachweisbar (selten tritt eine geringe Zellzahlerhöhung auf.)
– Am häufigsten wird bei der ED eine autochthone Gesamt-IgG-Produktion gefunden. Selterner findet sich auch IgM. Bei einer Neuroborreliose wird häufig IgG und IgM (und auch IgA) gefunden.
Verantwortlich für den Inhalt:
Dr. med. Friedemann Tewald (0711-6357-119)
Stand 11/2019
